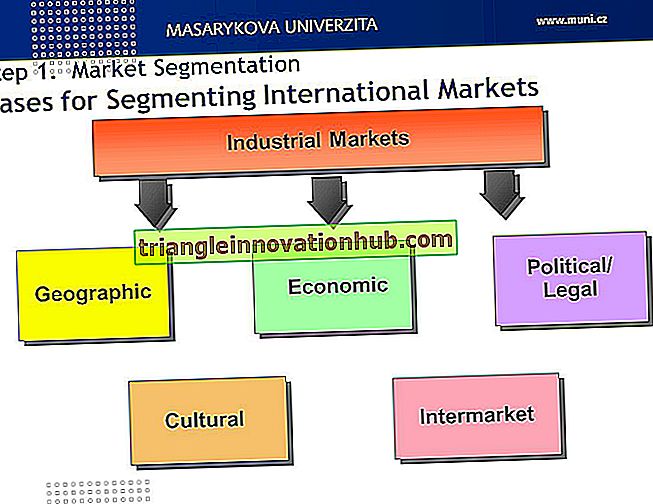
Nuttige opmerkingen over het lymfestelsel van het menselijk lichaam
Lees dit artikel om meer te weten te komen over het lymfestelsel van het menselijk lichaam!
Het bestaat uit een gesloten systeem van vaten die zich vertakken in de weefselruimten in en rond de bloedcapillairen en het weefselvloeistof in het bloedvaatstelsel brengt door als een alternatieve route te fungeren.

Afbeelding Courtesy: topknowhow.com/wp-content/uploads/2013/04/lymphatic-system.jpg
Het lymfestelsel is dus een hulpmiddel voor het veneuze systeem. In hun loop worden de lymfatische cellen onderschept door ketens van lymfeknopen die de lymfe filtreren en lymfocyten in de circulerende lymfe toevoegen.
lymfe:
Weefselvocht, wanneer het het lymfesysteem binnentreedt, staat bekend als de lymfe. De lymfe transporteert macromoleculen van eiwitten en grote deeltjes (stof, koolstof, bacteriën, kankercellen etc.) weg van de weefselruimten. Eiwitconcentratie van lymfe afgeleid van de meeste van de perifere weefsels is ongeveer 2 gm procent, en dit is bijna identiek met de eiwitconcentratie van weefselvloeistof. De vorming van lymfe is recht evenredig met de vorming van weefselvocht.
Mechanisme voor de vorming van weefselvloeistof (Fig. 10-1):
(1) Op het slagaderlijke uiteinde van capillair:
Hydrostatische druk (uitgaande kracht) = 30 mm Hg.
Eiwitosmotische druk (inwaartse trekkracht) = 25 mm Hg Filtratiedruk (30-25) = 5 mm Hg. Daarom verschijnen de meeste kristalloïden en zuurstof van het bloedplasma in de weefselruimte voor voeding van de weefselcellen.
(2) Aan het veneuze uiteinde van capillair:
Hydrostatische druk = 12 mm Hg. (naar buiten rijden)
Eiwit-osmotische druk -25 mm Hg. (naar binnen trekken)
Daarom worden de meeste kristalloïden en micromoleculen van de colloïden van de weefselvloeistof samen met kooldioxide geabsorbeerd door de semi-permeabele endotheliale wand van het veneuze uiteinde van de capillair. Maar de weefselvloeistof bevat intussen macromoleculen van colloïden uit de weefselmetabolieten; soms kunnen deeltjesvormige stoffen aan de vloeistof worden toegevoegd.
Deze materialen van de weefselvloeistof (colloïden en deeltjes) worden in het lymfatische systeem geabsorbeerd door de zeer permeabele endotheliale wand van de lymfatische haarvaten. Ongeveer een tiende van de weefselvloeistof, rijk aan eiwitgehalte, komt in de lymfevaten. Een van de essentiële functies van de lymfatische kanalen is het handhaven van een lage eiwitconcentratie van weefselvloeistof, omdat dit de enige manier is waarop overtollige eiwitten kunnen terugkeren naar het circulatiesysteem.

Functies van het lymfestelsel:
(1) Het helpt het veneuze systeem om colloïde componenten en deeltjesdeeltjes van de weefselvloeistof af te tappen;
(2) Helpt bij de opname van verteerd vet direct in de cisterna chyli. Twee derde van het vet wordt geabsorbeerd door het lymfestelsel;
(3) Het filtert de deeltjesmaterie en schadelijke stoffen van lymfe door de fagocytische werking van de macrofaagcellen van de lymfeknopen;
(4) Produceert lymfocyten door de lymfatische follikels van de lymfeknopen;
(5) Produceert immuunsubstanties (antilichamen) door de plasmacellen van de lymfeknopen;
(6) Onder pathologische omstandigheden biedt het kanalen voor de verspreiding van infecties of kwaadaardige cellen. Antioxisch serum geïnjecteerd in de weefselruimte wordt geabsorbeerd door de lymfatische; cobra-gif wordt gedeeltelijk geabsorbeerd door bloedcapillairen en gedeeltelijk door lymfevaten.
Onderdelen van het lymfestelsel:
(A) Lymfsvaten
(1) Lymfcapillairen
(2) Eigenlijke lymfevaten
(3) Terminal lymfekanalen
(B) lymfoïde weefsel
(1) Primaire lymfatische follikels
(2) Lymfeknopen
(3) hemolymfeklieren
(4) Thymus
Lymfevaten
Lymph Capillairen (Fig. 10-1):
Deze beginnen blindelings in de weefselruimten rond de bloedcapillairen en communiceren vrij met de aangrenzende lymfcapillairen. De capillairen zijn valveless, bekleed met afgeplat endothelium dat verstoken is van bepaalde basale lamina- en pericytecellen en zijn verankerd aan de vezels van bindweefsel. Daarom kunnen de lymfcapillairen niet instorten tijdens verhoogde druk van weefselvloeistof. De endotheelcellen van capillairen zijn niet met elkaar verbonden door nauwe overgangen.
De randen van endotheelcellen overlappen elkaar op een zodanige manier dat een flapklep wordt gevormd tussen de naburige cellen zodat het weefselvocht de lymfcapillairen kan binnendringen, maar de omgekeerde lymfekeerstroom terug naar de weefselruimte wordt voorkomen door de flapklep ( Fig. 10-2). De wanden van de haarvaten zijn zeer permeabel voor de macromoleculen van colloïden. De lymfe die in de haarvaten verschijnt, is multifibraal in de richting. De lymfcapillairen zijn afwezig in de volgende gebieden:
(a) Avasculaire structuren-epidermis, hoornvlies en gewrichtskraakbeenkraakbeen;
(b) miltpulp en beenmerg;
(c) Leverkwabje en longeenheden;
(d) Hersenen en ruggenmerg.

Factoren die de weefselvloeistof helpen de lymfcapillairen binnen te dringen:
(1) Filtratiedruk van de weefselvloeistof. Onlangs is ontdekt dat de weefselvloeistofdruk sub-atmosferisch is in de mate van ongeveer -6 mm tot -7 mm Hg. En colloïde osmotische druk van weefselvloeistof uitgeoefend door laag proteïne concentratie is ongeveer 5 mm Hg. (Raadpleeg Medical Physiology - Guyton) Ondanks negatieve druk komt de weefselvloeistof in de lymfatische haarvaten door de zuiging veroorzaakt door de lymfatische pomp die de lymfestroom stimuleert. Een dergelijke negatieve weefselvloeistofdruk helpt bij het vasthouden van de verschillende weefsels van het lichaam. Wanneer de weefselvloeistofdruk positief wordt, ontwikkelt zich het oedeem.
(2) Diffusie van kristalloïden door het semi-permeabele membraan;
(3) Colloïden komen het lumen van capillairen binnen via de klepkleppen tussen de endotheelcellen door een soort zuigwerking.
Lymph Vessel Proper:
De lymfevaten hebben een kraaltje, zijn voorzien van kleppen en zijn talrijker dan aders. De vaten bestaan uit oppervlakkige en diepe sets. De oppervlakkige vaten liggen in het subcutane isolaire weefsel en begeleiden de aderen. De diepe vaten bevinden zich onder dekking van diepe fascia en begeleiden de slagaders.
Structuur van een middelgroot lymfevat:
(a) Drie lagen van binnen naar buiten - Tunica intima is bekleed met endotheel. Tunica-media bestaat uit circulair gerangschikte gewone spieren. Tunica uitwendig bestaat uit vezelig weefsel.
(b) De vaten zijn voorzien van talrijke kleppen die semilunar zijn en in paren zijn gerangschikt; de vrije randen van de kleppen zijn gericht langs de lymfestromen. Nabij de kleppen zijn de wanden verwijd; vandaar gerolde uiterlijk.
Eigenaardigheden van de schepen:
(1) Lymfe stroomt slechts in één richting (niet-centrifugaal), geleid door de kleppen.
(2) Retrograde stroming kan plaatsvinden als de vaten worden belemmerd door de scheiding van de kleppen.
(3) Soms eindigen lymfevaten in afgelegen lymfeklieren en omzeilen de onmiddellijke knopen via pericapsulaire plexus. Een druppel lymfe in een capillair kan verbijsterd en variabel door de ingewikkelde plexus van vochtvrije lymfcapillairen gaan, afhankelijk van de plaatselijke omstandigheden. Maar zodra de lymfe verschijnt in de juiste vaten die zijn voorzien van kleppen, wordt zijn route onveranderlijk.
Soms zijn de accounts van lymfedrainage zoals beschreven door verschillende werknemers niet volledig met elkaar in overeenstemming. Waarschijnlijk hebben alle werknemers onder verschillende omstandigheden gelijk in hun respectievelijke beschrijvingen. Het is opmerkelijk om te vermelden dat de lymfedrainage van bepaalde organen onder pathologische omstandigheden verschilt van de drainage wanneer de organen gezond zijn.
Terminal Lymph-kanalen:
Dit zijn thoracale duct en rechter lymfatische duct, en eindigen respectievelijk in linker en rechter brachio-cephalic aders. Het thoracale kanaal draineert de lymfe uit het hele lichaam behalve de rechterkant van hoofd en nek, rechter bovenste extremiteit, rechter thoracale wand, rechter long, rechterkant van het hart en een deel van het convexe oppervlak van de lever. De snelheid van de lymfestroom door het thoracale kanaal van een rustende man is ongeveer 100 ml per uur.
Factoren die de lymfestroom reguleren:
ik. Filtratiedruk van de weefselvloeistof.
ii. Masserende werking van de skeletspier; dit is een zeer belangrijke factor.
iii. Overgebrachte pulsatie van de slagaders.
iv. De kleppen zetten de vaten om in kleine segmenten en richten de stroom.
v. Zwaartekracht.
vi. Afzuiging van het diafragma en negatieve druk op de brachocefalische aderen.
Lymfoïde weefsel:
Het is een gemodificeerd bindweefsel en bestaat uit ondersteunende structuren en cellen. De ondersteunende structuur wordt gevormd door het plexiform netwerk van reticulaire vezels die in hun tussenruimten talrijke cellen bevatten. De cellen zijn van twee soorten - gefixeerd en gratis.
De gefixeerde cellen zijn de reticulaire cellen die aan de reticulaire vezels zijn bevestigd en die fagocytisch in functie zijn. De reticulaire cellen staan bekend als litorale cellen en fungeren als stamcellen waaruit vrije cellen zijn afgeleid. De vrije cellen bestaan uit lymfoblasten, lymfocyten en plasmacellen en nemen de tussenruimten tussen de reticulaire vezels in beslag.
De plasmacellen worden gevormd uit de B-lymfocyten, wanneer de laatste door de antigenen worden geïnduceerd in immunologisch competente cellen die bekend staan als de immunoblasten. De immunoblasten worden opgevolgd door plasmoblasten, pro- plasmatocyten en plasmacellen. Elke plasmacel produceert een specifiek circulerend antilichaam voor een bepaald antigeen.
Zodra plasmacellen één soort antilichaam produceren, is het permanent verplicht om dat type antilichaam alleen te produceren dat specifiek is voor het bovengenoemde antigeen. De lymfocyten zijn van twee variëteiten - thymus-afhankelijke cellen, de T-lymfocyten, die zich bezighouden met cel-gemedieerde immuniteit en vertraagde overgevoeligheidsreactie; thymus-onafhankelijke cellen, de B-lymfocyten, die via de plasmacellen humorale antilichamen produceren. De lymfoblasten zijn afgeleid van T- en I-lymfocyten en vergroot op antigene stimulering voordat ze zich in kleine lymfocyten splitsen.
Antigenen wij, vreemde substanties die bij het verkrijgen van toegang tot het lichaam een immunologische reactie van de gastheer produceren voor zelfbescherming door vreemde stoffen te inactiveren of te vernietigen. De reactie kan de vorm hebben van cellulaire immuniteit die voornamelijk wordt gemedieerd door T-lymfocyten (T-cellen), of humorale immuniteit die wordt geproduceerd door plasmacellen die zijn afgeleid van В-lymfocyten (--cellen), of het meest gebruikelijk door beide methoden. Antigenen moeten vreemd zijn en het lichaam moet ze als vreemd herkennen.
De herkenning tussen de eigen en niet-eigen antigenen ontwikkelt zich in het intra-uteriene leven mogelijk met behulp van de thymus. Antigenen kunnen aanwezig zijn in hele cellen (bijvoorbeeld bacteriën, tumorcellen) of in macromoleculen van eiwitten, polysacchariden of nucleoproteïnen. Als algemene regel zijn moleculen groter dan 10.000 molecuulgewicht matig immunogeen. Chemische verbindingen met een kleiner molecuulgewicht kunnen werken als antigenen wanneer ze aan grote moleculen zijn bevestigd; dergelijke kleinere moleculen zijn bekend als haptens.
De specificiteit van de immuunrespons wordt geregeld door relatief kleine moleculaire eenheden, de antigene determinanten van de antigenen. Antigene determinanten voor eiwitten bestaan uit 4-6 aminozuren en die voor polysacchariden zijn monosaccharide-eenheden. Een bacteriële cel die veel antigene determinanten heeft, zal een breed spectrum van cellulaire en humorale responsen opwekken. Antigenen die immunologische respons produceren zijn bekend als immunogenen.
De antigenen zijn afgeleid van micro-organismen (virussen, bacteriën, schimmels, parasieten en wormen), van genetisch ongelijke cellen van weefseltransplantaat of van enkele van de lichaamscellen van de gastheer die vijandig worden en een auto-immuunreactie produceren. Kankercellen werken ook als antigenen.
Antilichamen of immunoglobulines zijn circulerende macromoleculaire plasmaproteïnen afgescheiden door de plasmacellen van de gastheer. De laatste is afgeleid van geactiveerde B-lymfocyten door een antigeen om een specifiek antilichaam tegen dat antigeen te produceren door de plasmacellen met als doel de werking van antigeen te inactiveren of te neutraliseren.
Het molecuulgewicht van de antilichamen varieert tussen 150.000 en 950.000. Elk antilichaammolecuul is samengesteld uit vier polypeptideketens, één paar identieke zware (H) -ketens en één paar identieke lichte (L) -ketens, gebonden door disulfidebindingen.
Het hele molecuul lijkt op de letter 'Y'. Elk van de divergerende ledematen bestaat uit één zware en één lichte keten en fungeert als antigeenbindingsplaatsen. De stam van 'Y' wordt alleen gevormd door de plaatsing van twee zware kettingen; het fungeert als receptorbindingsplaatsen en verschaft de plaats voor complementbinding.

Twee soorten L-ketens, Kappa (к) en Lambda (λ) zijn bij de mens aangetoond op basis van de aminozuursequentie van het constante gebied. Een bepaald antilichaammolecuul bevat altijd identieke or of λ-ketens, nooit een mengsel van de twee (figuur 10-3).
Vijf klassen van H-ketens zijn gevonden bij de mens, gebaseerd op structurele verschillen in de constante regio's. De verschillende vormen van H-ketens, aangeduid als y, a, p, 8 en e, worden gevonden in IgG, IgA, IgM, IgD en IgE.
Elke polypeptideketen bestaat uit een aantal lussen of domeinen van constante grootte gevormd door intra-keten disulfidebindingen. Het N-terminale domein van elke keten vertoont veel meer variatie in aminozuursequentie dan de andere en wordt aangeduid als variabel domein; andere regio's worden in elke keten constant domein genoemd. Wanneer behandeld met enzym papaïne, spuit het immunoglobulinemolecuul in drie fragmenten van vergelijkbare grootte; twee Fab (antigeenbinding) fragmenten die één gehele lichte keten en het VH- en CHi- domein van een zware keten omvatten; één Fc (crystaliseerbaar) fragment samengesteld uit С-terminale helften van zware keten. De Fc-regio's reageren met specifieke receptoren van veel verschillende cellen en met complementfixatie.
Klassen van Immunoglobulin's:
Vijf klassen worden herkend in de mens:
1. IgG:
Het is de meest voorkomende klasse, vormt ongeveer 75% van het totale serumimmunoglobuline en bestaat in monomeervorm. Het is het enige immunoglobuline dat de placentabarrière passeert en de pasgeborene beschermt tegen infectie.
2. IgA (figuur 10-4):
Het is het overheersende immunoglobuline in het mucosale immuunsysteem en aanwezig in speeksel, tranen, bronchiënafscheiding, het neusslijmvlies, prostaatvocht, vaginale secretie en slijmafscheiding van de dunne darm.
Het secretoire IgA wordt in dimeervorm gevonden en bestaat uit twee moleculen van monomeer IgA verenigd door een proteïne J en gecombineerd met een ander eiwit, de uitscheidende component. IgA-monomeren en proteïne J worden uitgescheiden door plasmacellen in de slijmvliezen die de spijsverterings-, ademhalings- en urinekanalen bekleden; de secretoire component wordt gesynthetiseerd door de mucosale epitheelcellen.
Het secretoire IgA is resistent tegen de proteolytische spijsverteringsenzymen. IgA bestaat normaal in serum in zowel monomere als polymere vormen, en vormt ongeveer 15% van de totale serumimmunoglobulinen.

3. IgM (figuur 10-5):
Het vormt 10% serumimmunoglobuline en bestaat als een pentameer met een molecuulgewicht van ongeveer 900.000. Het is het dominante immunoglobuline in vroege immuunreacties en wordt samen met IgD gevonden op het oppervlak van B-lymfocyten.
IgM en IgD vertonen zowel membraangebonden als circulerende vormen. Membraangebonden IgM en IgD dienen als receptoren voor specifieke antigenen, die proliferatie en differentiatie van B-lymfocyten helpen produceren, waarbij cellen worden geproduceerd die antilichamen afscheiden. IgM activeert ook het complementsysteem, een groep van plasma-eiwitten die het vermogen hebben om lysis van cellen te produceren, inclusief de bacteriën.

4. IgE:
Het bestaat meestal als een monomeer en heeft een grote affiniteit voor receptoren in de plasmamembranen van mestcellen en basofielen (cytofiel antilichaam). Onmiddellijk na zijn uitscheiding door plasmacellen hecht IgE zich aan deze cellen en verdwijnt vrijwel uit het bloedplasma en vormt slechts 0, 004% van de totale serumimmunoglobuline.
Wanneer een specifiek antigeen dat IgE-antilichaam produceert opnieuw wordt aangetroffen, wordt het antigeen-antilichaamcomplex gevormd op het oppervlak van mestcellen en de laatste produceert een allergische reactie door het vrijmaken van histamine, heparine, leukotriënen en ECF-A (eosinofiel-chemotactische factor van anafylaxie). ). Dergelijke antigenen staan bekend als allergenen.
5. IgD:
Het bestaat als een monomeer en is normaal aanwezig in sporen van ongeveer 0, 2% van de totale serumimmunoglobuline. De functies van IgD worden niet volledig begrepen. Omdat IgD (samen met IgM) wordt gevonden op het plasmamembraan van B-lymfocyten, is het betrokken bij de differentiatie van deze cellen.
Verdeling van lymfoïde weefsel:
1. Primaire lymfefollikels
2. Lymfeknopen
3. Hemolymphep en hemalknopen
4. Thymus
Primaire lymfefractelen (Fig. 10-6):
Elk primair follikel of lymfoïde weefsel bestaat uit een verzameling van В- en T-lymfocyten die worden ondersteund door reticulaire vezels. Het midden van de follikel staat bekend als kiemcentrum dat wordt bezet door lymfoblast. De periferie van de follikel bestaat uit vrije lymfocyten en plasmacellen.

De primaire follikels zijn aanwezig in het losse bindweefsel van het natte epitheliale membraan van de bovenste luchtwegen, spijsverterings- en urinewegkanalen. Ze bestrijden de ingang van antigenen van de buitenwereld. De follikels zijn ook aanwezig in de lymfeklieren en in de milt. Het mucosa-geassocieerde lymfoïde weefsel (MALT) met betrekking tot darm en bronchiën zijn respectievelijk bekend als GALT en BALT.
Eigenaardigheden van de primaire follikels:
(a) Afwezigheid van definitieve fibreuze capsule;
(b) De follikels filtreren weefselvloeistof en fungeren als tweede verdedigingslinie van het lichaam;
(c) Geen afferente vaten hebben, maar voorzien zijn van efferente vaten.
Lymfeklieren:
De lymfeklieren zijn meestal gerangschikt in groepen en bevinden zich vaak langs de bloedvaten. Ze zijn variabel in vorm en grootte. Gemiddeld is elke lymfeknoop boonvormig en heeft deze een hilum dat hechting geeft aan een enkel efferent lymfevat. Ongeveer 800 lymfeklieren zijn aanwezig in het menselijk lichaam.
Structuur van een lymfeknooppunt (figuur 10-7):
Elke knoop bestaat uit een capsule en klierstof.
De vezelige capsule investeert de gehele knoop en wordt van de klierstof gescheiden door een sub-capsulaire ruimte die de uiteinden van talrijke afferente lymfevaten ontvangt. Een aantal trabeculae steken uit de capsule in de klierstof.
De sub-capsulaire ruimte wordt doorkruist door grove reticulaire vezels waaraan de reticulaire cellen zijn bevestigd. De klier substantie bestaat uit de buitenste cortex en innerlijke merg.
De cortex presenteert het volgende:
(a) Talrijke trabecula strekken zich naar binnen uit vanuit de capsule en brengen de bloedvaten over. Elke trabecula wordt vergezeld door para-trabeculaire ruimten die natuurlijk reticulaire vezels omvatten en continu zijn met sub-capsulaire ruimte.
(b) De gebieden tussen de para-trabeculaire ruimten worden bezet door fijne reticulaire vezels, waarvan de tussenruimten zijn gevuld met de cellen van de primaire lymfefollikels. Elke follikel bestaat uit een kiemcentrum in het midden dat lymfoblast bevat, en vrije lymfocyten en plasmacellen aan de periferie.

In de medulla verdelen de trabeculaire zich in talrijke septa. De ruimten tussen de septa worden ingenomen door onregelmatige koorden van lymfocyten die bekend staan als medullaire koorden. Uiteindelijk bereiken de koorden de hilum van de lymfeknoop waaruit het enkele efferente lymfevat ontstaat.
Het structurele raamwerk van een lymfeklier bestaat uit capsule-, trabeculaire en reticulaire vezels. De tussenruimten van reticulaire vezels zijn gevuld met vaste reticulaire cellen en vrije lymfocyten en plasmacellen.
Eigenaardigheden van lymfeklieren:
(a) Aanwezigheid van fibreuze capsule:
(b) Filter lymfe;
(c) Aanwezigheid van afferente en efferente lymfevaten.
Functies van lymfeklieren:
(1) De lymfeknopen filteren de lymfe en verwijderen de deeltjes en schadelijke stoffen (koolstof, stof, bacteriën, kankercellen) door de fagocytische werking van de reticulaire cellen, wanneer de lymfe door de subcapsulaire en para-trabeculaire ruimten sijpelt. Virussen worden echter niet gefilterd door de knooppunten.
(2) Ze produceren lymfocyten die worden uitgewassen van de lymfefollikels in de efferente lymfevaten
Het totale aantal lymfocyten afgegeven door het thoratale kanaal in 24 uur is ongeveer 2, 5 maal het aantal lymfocyten dat aanwezig is in de bloedstroom op elk willekeurig moment. Het handhaven van een constante lymfocytentelling in het bloed wordt verschaft door de hercirculatie van lymfocyten (Gowans) van de trabeculaire bloedcapillairen naar de para-trabeculaire ruimten van lymfeknopen en daarna gewassen in de efferente lymfvaten (Fig. 7).
(3) De plasmacellen van de primaire follikels produceren antilichamen die de werking van de antigenen van de bacteriën of andere vreemde middelen blokkeren.
(4) De B-lymfocyten bezinken in de oppervlakkige zone van de cortex en in de medullaire koorden van lymfeknopen, terwijl de T-lymfocyten zich gewoonlijk in de middenzone en diepe zone van de cortex bevinden.
Haemolymph en Haemal Nodes:
De hemolymfeknopen bestaan uit een mengsel van bloed en lymfe dat de tussenruimten van reticulaire vezels opvult. Deze klieren zijn zeldzaam bij de mens, maar kunnen worden aangetroffen in de retroperitoneale lymfeklieren.
Haemal knooppunten:
De milt is een hemelknoop en filtert het bloed door versleten erythrocyten, leukocyten, bloedplaatjes en microbiële antigenen uit de bloedsomloop te verwijderen. Het bestaat uit een capsule, trabeculae, reticulaire vezels, rode pulp en witte pulp gemaakt van primaire lymfefollikels. Elke follikel wordt excentrisch door een arteriole doorlopen. De T-lymfocyten liggen in de periarteriolaire lymfeschede en de B-lymfocyten bezetten de rest van de witte pulp (Fig. 10-8).

thymus:
De thymus is een asymmetrische tweelobbige structuur. Het bevindt zich in de superieure en voorste mediastina van de thorax en komt tussen het borstbeen vooraan en het pericardium, de aortawortel met zijn drie takken, de brachio-cephalische aderen en de luchtpijp achter. Het strekt zich uit tot onder het vierde ribbenkraakbeen; boven de thymus kan zich uitstrekken voor de trachea tot aan de onderste pool van de laterale kwabben van de schildklier. De twee lobben van de thymus zijn over de middellijn verbonden door fibro-areolair weefsel.
Bij de geboorte weegt de thymus ongeveer 10 gm tot 15 g; het neemt progressief toe in omvang tot aan de puberteit wanneer het ongeveer 20 g tot 30 g weegt. Daarna ondergaat de thymus involutie en wordt omgezet in fibro-vetmassa; in het midden van het volwassen leven bedraagt zijn gewicht ongeveer 10 gram.
Elke lob van de thymus ontwikkelt zich vanuit het endoderm van de derde keelholte en ondergaat caudale migratie in de thorax. De aanhechting van de thymische beginselen aan de primitieve farynx wordt vervolgens verbroken. De endodermale cellen blijven bestaan als koorden van reticulaire epitheelcellen.
Structuur van de thymus (figuren 10-9, 10-10):
Elke lob van de thymus is bedekt met een fibreuze capsule die in de substantie van het orgel uitsteekt als onvolledige trabeculaire septa. De trabeculaire septa brengt de bloedvaten over en verdeelt de thymus in talrijke lobules; elke lob is ongeveer 1 mm tot 2 mm breed. De lobben bestaan uit de buitenste cortex en de binnenste mergrand. De cortex bevat dicht opeengepakte talrijke lymfocyten en incidentele macrofaagcellen.
In de medulla zijn de lymfocyten minder in aantal; daarnaast bevat het concentrische lichaampjes van Hassall. Sommige bloedvaten van de trabeculaire septa doorkruisen de overgang tussen de cortex en de medulla en verdelen zich in cortiale en medullaire haarvaten. De thymus is verstoken van lymfcapillairen.


Enkele details over de structuur:
Vier speciale variëteiten van structuren worden aangetroffen in de thymus. Dit zijn reticulaire epitheelcellen, lymfocyten, macrofagen en Hassal's bloedlichaampjes.
De reticulaire epitheelcellen van een continue laag die het binnenoppervlak van de fibreuze capsule, trabeculaire septa en rond de bloedvaten op de cortico-medullaire junctie en corticale en medullaire haarvaten vormt. De reticulaire cellen zijn met elkaar verbonden door demosomen. Onregelmatige vertakkingskoorden van reticulaire epitheelcellen stammen meer in de cortex en medulla in de eerste. De tussenruimten tussen de reticulaire cellen zijn gevuld met talrijke lymfocyten en incidentele macrofagen. Van de antigeenmacromoleculen van het circulerende bloed wordt voorkomen dat ze in contact komen met de thymische lymfocyten door de aanwezigheid van Haemo-Thymic Barrier.
De barrière bestaat uit het volgende van buiten naar binnen - een laag van continue endotheelcellen van capillairen; een dik basismembraan; een weefselruimte die af en toe weefselvloeistof bevat; een continue laag van reticulaire epitheelcellen (Fig. 10-11). Hoewel de barrière ondoordringbaar is voor antigenen, worden voedingsstoffen en stamcellen uit het beenmerg door de barrière naar de thymus getransporteerd. Bovendien gaan thymus lymfocyten door de barrière in het circulerende zwembad.
De lymfocyten in de thymus zijn afgeleid van de stamcellen van het beenmerg. De lymfocyten prolifereren asymmetrisch in een antigeenvrije omgeving. Sommige van de cellen worden bewaard als stamcellen voor daaropvolgende celdelingen, terwijl de andere cellen herhaaldelijk prolifereren door mitose om talrijke kleine lymfocyten te vormen.
Deze cellen worden dikker bevolkt in de cortex dan de medulla en ze bezetten de tussenruimten tussen de reticulaire epitheelcellen. 90% gewicht van de thymus wordt bijgedragen door de lymfocyten. De meeste thymus lymfocyten (90%) zijn van korte duur met een levensduur van 3 tot 5 dagen. Waarschijnlijk worden deze cellen auto-allergeen voor elkaar of voor de gastheer en ondergaan ze een vroege desintegratie. De gedegenereerde lymfocyten worden door de macrofagen gefagocytoseerd. Ongeveer 5% van de overlevende lymfocyten verschijnen in de circulerende poel via de hemothymische barrière als niet-gecommitteerde immunologisch competente cellen, en recirculeren in de primaire lymfatische follikels van de perifere organen van het lymfatische systeem.
De thymus fungeert als een centraal orgaan van het lymfatische systeem en verschaft ongecommitteerde lymfocyten die reageren op variëteiten van nieuwe antigenen, terwijl de lymfocyten van de perifere organen verplicht zijn om te reageren met specifieke antigenen. Bovendien reguleert de thymus de proliferatie van lymfocyten zowel binnen de thymus als in de perifere lymforganen, bijv. Lymfeknopen.
De middelste en de diepe zones van lymfeklieren worden beschouwd als zwezerikafhankelijke gebieden. De lymfopoëse in de thymus en in perifere organen wordt waarschijnlijk gereguleerd door een humorale factor, het lymfopoietine, dat wordt gevormd door de reticulaire epitheelcellen van de thymus. Thymische lymfopoëse en lymfolyse zijn automatisch en worden alleen door de zwezerik gecontroleerd.

De reticulaire epitheelcellen van de medulla zijn meer eosinofiel. Sommige van deze cellen ondergaan zwelling en de kernen zijn gefragmenteerd. Dergelijke gedesintegreerde cellen vormen individuele centrale hyalinzingmassa's. Elke centrale massa wordt concentrisch omringd door lagen van eosinofiele epitheelcellen en vormt het bloedlichaam van Hassall. De macrofaagcellen die gefagocytyeerde lymfocyten bevatten worden ingebracht in de concentrische Hassal's bloedlichaampjes. Deze bloedlichaampjes hebben een diameter van ongeveer 30 tot 100 μm en zijn talrijk tijdens de involutie van de thymus.
Effecten van hormonen op de Thymus:
De groeihormonen van de hypofysevoorkwab en de schildklierhormonen stimuleren de thymus om te groeien voordat de puberteit wordt bereikt. De aanwezigheid van steroïdhormonen uit de suprarente cortex en uit de geslachtsklieren bevordert de involutie van de thymus, die vaak wordt waargenomen in het postpuberale leven.
Castratie of adrenalectomie in het vroege leven vertraagt de involutie van de thymus. Aan de andere kant produceert de toediening van cortison (suprarenaal corticaal hormoon) vroege involutie van de thymus en onderdrukt lymfopoëse van het gehele lymfatische systeem.
Functies van Thymus:
In de afgelopen paar jaar hebben studies over de thymus enkele fascinerende en nuttige functies onthuld, die tot nu toe onontgonnen waren.
(1) De thymus werkt als een centraal orgaan van het lymfatische systeem en verschaft niet-gecommitteerde immunologisch competente lymfocyten aan de circulerende poel en aan de perifere lymforganen. Thymische lymfocyten (T-lymfocyten) groeien in een antigeenvrije omgeving en leveren ongecommitteerde cellen die kunnen reageren met variëteiten van nieuwe antigenen.
(2) Het is essentieel in de vroege weken van het neonatale leven en reguleert de groei van perifeer lymfoïde weefsel. Cortison-toediening aan de pasgeborene is schadelijk omdat het de normale immunologische reactie belemmert.
(3) De thymus is vergroot bij sommige auto-immuunziekten, bijv. Myesthenia gravis. In myesthenia gravis ontwikkelen bepaalde vrijwillige spieren vroege vermoeidheid na enkele aanvankelijke weeën. Thymectomie in deze toestand verlicht de symptomen. Waarschijnlijk bevrijdt de thymus een curare-achtige remmersubstantie die de neuromusculaire transmissie blokkeert.
Cells in Immune Response:
Om de invasie van enorme variëteiten van antigenen te weerstaan, wordt het lichaam voorzien van drie groepen cellen voor zelfverdediging-В lymfocyten (B-cellen), T-lymfocyten (T-cellen) en Antigen-presenterende cellen (APC's)
Wanneer ze niet actief zijn, zijn zowel de В- als de T-cellen kleine lymfocyten met een diameter van 6-10 pm, en elk bezit een sferische kern en een dunne rand van schaars cytoplasma rond de kern. Maar wanneer ze worden blootgesteld aan specifieke antigenen, worden de cellen geactiveerd om grote lymfocyten te vormen en differentiëren ze in effector В- en T-lymfocyten. Zowel В als T-cellen variëren in levensduur; sommigen leven slechts een paar dagen, terwijl anderen vele jaren in het circulerende bloed overleven (geheugencellen).
В-lymfocyten (Fig. 10-12 en 10-13):
Bij zoogdieren wordt algemeen aangenomen dat de voorlopers van В-cellen worden verwerkt in het beenmerg, waar ze differentiëren in speciale micro-omgeving tot rijpe of effector-lymfocyten na herhaalde mitose. Bij vogels zijn de cellen echter afkomstig van een endodermale zak, de slijmbeurs van Fabricius, bevestigd aan de achterste darm; vandaar de naam B-lymfocyten of bursa-equivalente lymfocyten. Maar het bestaan van dergelijke cloaca slijmbeurzen is twijfelachtig in zoogdieren.
Volwassen of effector cellen verlaten het beenmerg en vestigen zich in: (a) lymfeklieren in de oppervlakkige zone van de cortex; (b) in de witte pulp van de milt buiten de peri -arteriolaire lymfatische omhulling; (c) in het diffuse lymfoïde weefsel onder het slijmvlies van ademhalings-, voedings- en urinewegsystemen; (d) sommige vrije cellen circuleren in het bloed. Ongeveer 20% van de circulerende lymfocyten behoren tot В cellen.
Wanneer ze door specifieke antigenen worden geactiveerd, prolifereren de effectorcellen door mitose en differentiëren ze tot plasmacellen die circulerende antilichamen of immunoglobulinen uitscheiden, die antigeenspecifiek zijn. Dus В cellen, plasmacellen en antilichamen vormen de basis van humorale immuniteit (vide supra). Differentiatie van В-cellen in plasmacellen wordt ondersteund door de lymfokinen die worden uitgescheiden door helper-T-lymfocyten en door de membraan-gebonden IgM- en IgD-antilichamen. Sommige geactiveerde cellen blijven bestaan als voorgeprogrammeerde geheugencellen die een snelle immuunrespons zullen produceren bij latere blootstelling door dezelfde specifieke antigenen.
В cellen herkennen antigeen via een antigeen-receptorcomplex. IgM, aanwezig op het oppervlak van alle В-cellen, vormt de antigeenbindende component van de В-celreceptor. Verschillende andere moleculen op het oppervlak van B-cellen zijn essentieel voor de В-celfunctie. Deze omvatten complementreceptoren, Fc-receptoren en CD40. Het CD40-molecuul speelt een belangrijke rol in de interactie van T-helpercellen en B-cellen. Deze interactie is essentieel voor de rijping van В-cellen en de uitscheiding van IgG, IgA en IgE.
T-lymfocyten (zie figuur 10-12, 13):
De primitieve stamcellen van T-lymfocyten zijn afkomstig van het beenmerg en verlaten de mergruimte door het bloedsomloopstelsel om te verschijnen in de thymus, waar de T-cellen immuno-competente volwassenheid ontwikkelen door herhaalde
mitose in een antigeenvrije omgeving vanwege de aanwezigheid van hemothymische barrière. De rijpheid van T-cellen wordt ondersteund door de thymus-reticulaire cellen en macrofagen. In dit proces worden veel lymfocyten die vijandig staan tegenover eigen antigenen herkend, vernietigd of onderdrukt door een onbekend mechanisme.
Overlevende T-cellen ontwikkelen zich tot immuno-competente cellen voor niet-antigenen, worden vrijgemaakt in ciuculatie en vestigen zich in de volgende gebieden: (a) lymfeknopen in het middengebied van de cortex (paracorticale zone); (b) periarteriolaire lymfatische omhulling van milt; (c) diffuse lymfoïde weefsels van mucosaal lymfatisch systeem; (d) vrije lymfocyten in het circulerende bloed. Ongeveer 75% van de circulerende lymfocyten zijn afgeleid van de T-cellen.
Wanneer gestimuleerd door antigeen, scheiden sommige T-cellen lymfokinen af, die alle peptiden of eiwitten zijn en de groei en differentiatie tussen verschillende groepen immuuncellen beïnvloeden. Lymfokinen zijn ook bekend als Interleukin.es (IL); er zijn tot nu toe meer dan zestien interleukines beschreven. Hiervan stimuleert IL 4, afgescheiden door T-cellen, de differentiatie van В cellen.
Alle T-cellen bezitten T-celreceptoreiwitten (TCR) aan het oppervlak, die specifiek antigeen herkennen dat vergelijkbaar is met dat van antilichamen. Omdat de T-cellen functioneren door andere cellen te richten en te recruteren zonder antilichaam af te scheiden, vormen ze de basis van cellulaire immuniteit. Ongeveer 5% lymfocyten in het bloed worden nulcellen genoemd. Ze hebben geen oppervlakte-antigenen van het T noch van het lymfocyt en worden verondersteld de circulerende stamcellen te zijn.

T-cel receptor:
TCR bestaat uit een disulfide-gekoppeld heterodimeer, een a- en ap-polypeptideketen in meerderheid van T-cellen, die elk een variabele (antigeenbinding) en een constant gebied hebben. In een minderheid van T-cellen is TCR samengesteld uit y en 5 polypeptideketens; dergelijke (y / 8) TCR-cellen hebben de neiging om te aggregeren aan het epitheliale oppervlak van de ademhalings- en GI-kanalen.
Beide typen TCR zijn gekoppeld aan een cluster van vijf polypeptideketens, bekend als CD3-moleculair complex. Ze zijn betrokken bij de transductie van signalen in de T-cel nadat het het antigeen heeft gebonden (Fig. 10-12).

Klassen van T-cellen:
Met de toepassing van monoklonale antilichamen tegen lymfocyten, is het nu mogelijk om de T-lymfocyten te classificeren door clusters van differentiaion (CD) als merkermoleculen op het celoppervlak. Alle echte T-cellen zijn CD3-positief; bovendien is CD4 positief voor helper-T-cellen en is CD8 positief voor cytotoxische en suppressor-T-cellen. Natural Killer-cellen zijn CD3-positief, maar dragen geen CD 4- en CD 8- markers. Dienovereenkomstig bestaan T-cellen uit vier subtype-helper-, cytotoxische, suppressor- en geheugen-T-cellen.
Antigeenherkenning door T-cellen:
Naast CD3-eiwitten brengen T-cellen een verscheidenheid aan functioneel geassocieerde moleculen tot expressie op het celoppervlak die CD4, CD8, CD28, CD40 en vele andere omvatten. Ongeveer 60% van de rijpe T-cellen zijn CD4 + en 30% CD8 +. Tijdens T-celactivering werken CD4-moleculen van helper T-cellen als co-receptoren en binden aan klasse II major histocompatibility complex (MHC) -moleculen op antigeen-presenterende cellen, terwijl CD8 + cytotoxische T-cellen cel-gebonden antigenen herkennen alleen in combinatie met klasse I MHC-moleculen.
Maar voor langdurige activering van zowel CD4 + en CD8 + T-cellen is een interactie nodig tussen het CD28-molecuul op T-cellen en B7- of B7-2-moleculen die tot expressie worden gebracht op antigeen-presenterende cellen. Anders zullen T-cellen desintegreren of niet-reactief worden (Fig. 10-14).
Helper-T-cellen ( TH ): deze spelen een zeer belangrijke rol van cellulaire immuniteit door lymfokinen af te scheiden, wanneer geactiveerd door een combinatie van antigeen en klasse II MHC (major histocompatibility complex) molecuul gebonden aan de plasmamap mambran van macrofaagcellen. Onlangs zijn twee subsets van helper-T-cellen herkend:
1) De TH- subset scheidt interleukine-2 (IL-2) en interferon-y (IFN-y) af. Het is betrokken bij het vergemakkelijken van vertraagde overgevoeligheid, macrofaagactivering en synthese van IgG-2b-antilichaam.
2) TH -2 subset produceert IL-4 en IL-5. Het helpt bij de synthese van andere klassen antilichamen.
De lymfokinen, ook cytokinen genoemd, vervullen de volgende functies:
ik. Stimuleer de proliferatie en rijping van cytotoxische en suppressor T-cellen;
ii. Interleukine 4, één variëteit van lymfokinen, activeert een kloon van onrijpe cellen om antilichamen door de plasmacellen tegen dat specifieke antigeen te produceren. TH- cellen zetten dus een aanval op dat antigeen op door zowel cellulaire als humoristische immuniteit.
iii. γ-interferon, secreted by T H cells, induces Class IIMHC expression and ac tivates the macrophages.
The main marker of T, cells is CD, molecule; hence called T 4 cells.

Clinical importance: Helper T cells are killed by HIV virus that causes Acquired Immune Deficiency Syndrome, AIDS. As a result, the immunity of the infected patients is crippled and renders them susceptible to the opportunistic infections.

Cytotoxic T Cells (T c ):
These cells kill the virus-infected and malignant cells, and 'alien' cells of an allograft. This is done by the release of toxic lysosomal proteins, the perforins, which produce holes in the cell membrane of the target cells.
The receptor proteins of the Tc cells recognise the pathological cells or genetically dissimilar graft cells by combining with alien antigen in combination with class I MHC molecules attached to the cell membrane of target cells. Tc celts are activated by the lymphokines of T H cells.
Natural Killer Cells (NK cells):
Their morphology and actions are almost similar to Tc cells, but they do not bear CD 4 or CD S markers. NK cells are activated by Interleukin 2 from T H cells. They liberate cytolysin and kill non- specifically virus infected cells, protozoa and other pathogenic cells.
Suppresor T Cells (Ts):
These cells inhibit the functions ot T H and T c cells, and modulate between positive and negative controls of immune response. This becomes imperative because excessive destruction of foreign invaders by powerful agents might involve the body itself in the form of autoimmune diseases, allergic asthama and allergic dermatitis.
CD S molecule acts as a marker of suppressor T cells.
T Memory Cells: On first exposure to an antigen, some clones of inactive T cells develop receptor surface proteins specific for that antigen, but themselves are not involved in immune response. These persist as memory T cells, which possess long span of life. When exposed to the same antigen on subsequent occasion, the response of memory T cells is prompt to challenge the invader.
Antigen presenting cells (APC cells):
The APCs are found in most tissues. They phagocytose the antigens, process them and retain the products for longer periods and gradually present them to the cell surface in combination with MHC protein molecules and activate the lymphocytes (Fig. 10-14).

The APCs constitute a heterogeneous population of cells that belong to the mononuclear phagocytes system (MPS). They include macrophages, epidermal Langerhans's cells, dendritic cells of lymphoid organs, reticular epithelial cells of the thymus, and microglia of the central nervous system.
Processing by APC:
Antigen is taken into an APC and partially fragmented. It is then bound to one of the class of histocompatibility antigens known as MHC protein and the entire molecular complex is exposed to the cell surface of the antigen presenting cells.
When the processed antigen meets a mature T cell bearing an appropriate receptor, it activates T cell. When the processed antigen is bound to class I MHC protein, it produces CD K bearing Tc or Ts cell response. In presence of class II MHC protein bound to processed antigen, it activates T H cell response, which in turn helps В cells to respond to the same antigen.